المهندس عباس فاضل عبدي
مقدمة عن الأمتزاز :
يستعمل مصطلح ال (sorption) لوصف كل نوع من أخذ أو خزن للمادة من قبل السطح الخارجي للمواد الصلبة (Adsorption)والسائلة (Absorption) وكذلك من قبل السطح الداخلي للمواد الصلبة المسامية أو السوائل.
ان الامتزاز هو عملية فصل يكون فيها الطور المائع في حاة تلامس مع طور الدقائق المسامية الصلبة ذي الخاصية الانتقائية لآخذ او لخزن واحد أو أكثر من المكونات الموجودة في الطور المائع.حيث أن المائع لايذوب في المادة الصلبة ولكن يلتصق على السطح ويحدث التوازن بين المائع الممتز وبين الذي يبقى في عمق طور المائع, ويعتبر الامتزاز خاصية اساسية من المادة ممتلكا قوى التجاذب بين الجزيئات,حيث ان حقل القوة بالقرب من سطح المادة الصلبة يخلق طاقة كامنة واطئة وكنتيجة فأن كثافة الجزيئات قرب السطح عموما يكون أعظم من كتلة الغاز.أن التطبيقات المهمة الكثيرة للآمتزاز يعتمد على الآنتقائية (Selectivity) أي الاختلاف في تجاوب السطح للمكونات المختلفة.
أن المادة التي تعاني الامتزاز على سطح المادة الصلبة تدعى ب(المادة الممتزة)Adsorbate
والمادة التي تقوم بالامتزاز تدعى ب (السطح الماز) Adsorbent
يعتبر الامتزاز من اكثر طرق الفصل أقتصادية خصوصا عندما يكون تراكيز المواد التي يجب أن تزال من الطور المائع قليلة جدا , وهي التقنية الاوسع استعمالا لفصل الجزيئات في صناعة النفط والغاز الطبيعي والبتروكيمياويات والصناعات الكيمياوية والعمليات البيئية . أن القوة الجاذبة المسببة للامتزاز عموما تكون ضعيفا قياسا للاواصر الكيمياوية وبزيادة درجة حرارة المادة المازة او بتقليل الضغط الجزئي للمادة الممتزة (أو التركيز في السائل)فأن المادة الممتزة يمكن تحريرها من السطح. أن عملية تحرير أو خطوة أعادة التنشيط هي خطوة مهمة في العملية , حيث تسمح عملية التنشيط أولا بأستخلاص المواد الممتزة وفصلها وبعد ذلك فهي تسمح باعادة استعمال المادة الصلبة لعدة دورات وفي قليل من الحالات فان الامتزاز يكون غير عملية والمادة الممتزة يجب ان تزال بالحل الحراري أو بتفاعل كيمياوي أخر أو ببساطة يتم الخلص من المادةالصلبة.
وتتوزع الجزيئات في الامتزاز بين طورين الاول في طور الصلب بينما الاخر في طور السائل أو الغاز , عكس عملية الامتصاص والتي ينتشر فيها جزيئات المذاب من طور الغاز الى طور السائل , وينتشر الجزيئات في الامتزاز من طور المائع الى سطح المادة الصلبة مكونا طورا ممتزا واضح المعالم.
ان المادة المازة المستعملة في فصل الغازات تستعمل لآزالة الكميات القليلة من المركبات من خليط الغازات , والمثال الشائع هو تجفيف الغازات لمنع التأكل والتكثيف أو لمنع تفاعل جانبي غير مرغوب فيه . يكون الامتزاز مؤثرا في أزالة المركبات القليلة من طور السائل ويستعمل لآستخلاص المركبات أو المواد المؤذية للصحة من التأثير الصناعي.
هناك فرق في كل عملية من عمليات التقطير والامتصاص والاستخلاص بين الخواص التي يتم فصلها . ففي عملية التقطير هناك التطايرية وفي الامتصاص الذوبانية وفي الاستخلاص معامل التوزيع , أما عملية الفصل بالأمتزاز فتعتمد على مكون واحد مستعد اكثر للأمتزاز عن الأخر . فعملية الفصل للبارافين الاعتيادي عن المتفرع بالتقطير يتطلب عدد مراحل كبيرة بسبب التطايرية النسبية الواطئة للمركبين. حييث يفضل من الناحية الاقتصادية أستعمال مادة مازة والتي تقوم بالفصل بناءا على الفرق في الاقطار الجزيئية للمركبين, وكمثال فأن البنتان الاعتيادي والآيزوبنتان لهما أقطار *(0.489 nm) و (0.558 nm) على التوالي فعندما يتم استعمال مادة مازة بحجم مسام (0.5 nm) لخليط الغازات فان الجزيئات الصغيرة سوف تنتشر من خلال سطح المادة المازة وتبقى فيها , بينما تستثنى الجزيئات الكبيرة . ويمكن استرجاع الجزيئات المتبقية في المادة الصلبة بتقليل الضغط أو رفع درجة الحرارة.
يحدث الامتزاز عندما تبقى الجزيئات المنتشرة في طور المائع فترة من الزمن بقوى صادرة من السطح القريب. يمثل السطح فجوة اجمالية في تركيبة المادة الصلبة , والذرات عند السطح لها بقايا لقوى الجزيئات والتي لاتكون مشبعة بالذرات المحيطة كما في بنية الجسم. هذه البقايا للقوى أو قوى فاندرفالز شائعة لكل السطوح والسبب الوحيد عن كون هذه المواد الصلبة مميزة هي أنها يمكن تصنيعها على شكل مسامات عالية معطيا زيادة في المساحة الداخلية . وبالمقبل فأن السطح الخارجي يساهم بشكل معتدل للمجموع الكلي حتى عندما يكون السطح مجزءا على نحو ممتاز. ان الامتزاز المبني على قوى فاندرفالز فيزياوي في الطبيعة لان القوى تكون ضعيفة والامتزاز يمكن عكسها بسهولة , ان كمية الحرارة المتولدة في الامتزاز الفيزياوي يكون مشابها في القيمة لحرارة التكثيف , وعندما لايتم تشتيت الحرارة بالتبريد فان حجم المادة الصلبة سوف تقل بارتفاع درجة الحرارة.
n=nano=10¯9*
من الملائم التفكير بان الامتزاز يحدث بثلاث مراحل , عندما يزداد تركيز المادة الممتزة يتكون أولا طبقة منفردة من الجزيئات على سطح المادة الصلبة , هذه الطبقة المنفردة يمكن ان يمتز كيميائيا ومقترنة بالطاقة الحرة والتي تمتز بالقوى التي تحملها , وعندما يزداد تركيز المائع فان الطبقات المتكونة بالامتزاز الفيزياوي وعدد الطبقات المتكونة يمكن أن تحدد بحجم المسامات . واخيرا فأن للامتزاز من طور الغاز تحدث التكثيف الشعري(capillary condensation) حيث ان الشعيرات تمتلئ بالمادة الممتزة المتكثفة ويصل ضغطها البخاري الى قمة حرجة نسبة الى حجم المسام.
تنجذب الجزيئات الى السطوح كنتيجة لنوعين من القوى: قوى التشتت dispersion وقوى التنافر repulsion (وتدعى بقوى فاندرفالز)وتكون كنتيجة بأن الجزيئة أو مجموعة السطح لها قطبية كهربائية ثنائية دائمة dipole أو عزم قطبي رباعي quadrupole أو شحنة كهربائية صافية.
تتواجد قوى التشتت دائما وفي غياب اي قوة قوية سوف يحدد سلوك التوازن كما في الامتزاز الجزيئات بعزم غير قطبي ثنائي أو قطبي رباعي على الكاربون الغير المؤكسد.اذا كان السطح قطبيا فسوف يقدم حقل كهربائي يحث عزم القطب الثنائي في الجزيئة بقطبية ثنائية غير دائمة ومن خلال هذا الاستقطاب فانه يزيد من الامتزاز .وبالتشابه فان الجزيئة بعزم قطبي دائم سوف تستقطب السطح الغير القطبي وبهذا تزيد من التجاذب.
ان التجاذب للسطح القطبي والجزيئات بعزم ثنلئي القطب الدائم يكون قويا كما في امتزاز الماء على مواد مازة محبة للماء hydrophilic .وبالتشابه للسطح القطبي فان الجزيئة بعزم رباعي القطبية الدائم سوف تنجذب بقوة اكثر من الجزيئة المشابهة بعزم ضعيف .مثال:يمتز النايتروجين بقوة اكثرمن الاوكسجين على سطح الزيولايت..
ان عملية الامتزاز باعثة للحرارة exothermic (وتشابه التكثيف condensation).
وعكس عملية الامتزاز desorption ماصة للحرارة endothermic(وتشابه التبخير evaporation).
ودرجة الحرارة الواطئة والصغط العالي مفضل في عملية الامتزاز .
ودرجة الحرارة العالية والضغط الواطئ مفضل في عكس عملية الامتزاز desorption.
انواع الامتزاز types of adsorption
يصنف الامتزاز معتمدا على نوع الاصرة الى:
- الامتزاز الفيزياوي physical adsorption أو physisorption
وتحدث عندما يكون القوى الجزيئية البينية أو قوى فاندرفالز للتجاذب بين جزيئات المائع وسطح المادة الصلبة أعظم من قوى التجاذب بين جزيئات المائع نفسه.حيث يلتصق جزيئات المائع على سطح المادة الصلبة الممتزة ويحدث التوازن بين المائع الممتز والذي يبقى في طور المائع.ولايلاحظ اي تغير في الالكترونات او بالاحرى يحدث تجاذب جزيئي بين موقع الطاقة المفضلة ولذالك لايعتمد على الخواص الالكترونية للجزيئات المتضمنة .يتسم الامتزازالفيزياوي بطاقات تداخل مساو او مشابه لحرارة التكثيف.المادة الممتزة يحتجز على السطح بقوى فاندرفالزضعيفة نسبيا ويمكن ان تتكون عدة طبقات من الجزيئات وبنفس حرارة الامتزاز تقريبا.حرارة الامتزازللامتزاز الفيزياوي يكون قليلا للمول الواحد) Kcal/mole ولذلك هذا النوع من الامتزاز مستقر فقط عند درجات الحرارة الاقل من 150° مئوية ,ويسمح الامتزاز الفيزياوي استعماله بعملية مراحل مستمرة .
- الامتزاز الكيمياوي chemical adsorption او chemisorptions
ويشمل التداخل الكيمياوي بين المائع الممتز المادة الصلبة المازة وفي معظم الحالات يكون الامتزاز غير قابلا للعكس ويكون صعبا فصل المادة المادة المازة عن المائع الممتز.ويشمل انتقال الالكترون بين مواقع السطح المحددة او المخصصة وجزيئات المذاب وكنتيجة تتكون الاصرة الكيمياوية.يتسم الامتزاز الكيمياوي بطاقلت التفاعل بيسن السطح والمادة الممتزة مشابهة او مساوية لقوة الاواصر الكيمياوية وبعشرات من الكيلوسعرة للمول الواحد) Kcal/mole وبناءا على ذلك تكون اقوى بكثير ومستقرا اكثر في الدرجات الحرارية العالية اكثر من الامتزاز الفيزياوي وعموما تتكون طبقة جزيئات منفردة فقط .
معظم تطبيقات الامتزاز في عمليات الفصل والتنقية تعتمد على الامتزاز الفيزياوي,بينما العوامل المساعدة الغير المتجانسة عموما يشمل الامتزاز الكيمياوي للمتفاعلات .
يستعمل الامتزاز الكيمياوي في بعض الاحيان في ازالة المواد الغير النقية الموجودة بكميات قليلة حيث يتم تحقيق انتقائية عالية وعلى الرغم من عدم استعمال الامتزاز الكيمياوي بشكل واسع كما في الامتزاز الفيزياوي فهنالك عدة تطبيقات في العمليات تعتبر هامة للامتزاز الكيمياوي لتنقية الغازات ومنها :
ازالة الزئبق : حيث ان الكميات القليلة من الزئبق الموجودة في الغاز الطبيعي معرفة بانها تسبب تاكلا لسطوح المبادلات الحرارية المصنوعة من الالمنيوم في وحدات صناديق التبريد المنخفضة درجة الحرارة في مصانع تسييل الغاز الطبيعي LNG , ويمكن ازالة الزئبق لمثل هذه الوحدات باستعمال كاربون فعال يحتوي على الكبريت وذلك بتفاعل الزئبق مع الكبريت مكونا كبريتات الزئبق .
وادناه جدول يبين فيها المقارنة بين الامتزاز الفيزياوي والامتزاز الكيمياوي :-
|
الامتزاز الفيزياوي |
الامتزاز الكيمياوي |
| 1.حرارة الامتزاز قليلة عند نفس درجة حرارة التسييل الطبيعي للغاز . | 1.حرارة الامتزاز اكبر بعدة مرات من حرارة التسييل الطبيعي للغاز. |
| 2.الامتزاز يكون بكمية محدودة فقط عند درجات الحرارة الاقل من نقطة غليان المادة الممتزة. |
2.يمكن ان يحدث الامتزاز عند درجات حرارية عالية. |
| 3.مقدار الزيادة في الكمية التي يمكن ان يمتز تزداد مع كل زيادة في ضغط المادة الممتزة . | 3.مقدار الزيادة في الكمية التي يمكن ان يمتز تنقص مع كل زيادة في ضغط المادة الممتزة. |
| 4.طاقة التنشيط ليست ذات قيمة. | 4.طاقة التنشيط عالية تبعا للتفاعل الكيمياوي. |
| 5.تحدث طبقات ممتزة متعددة . | 5.تتكون طبقة واحدة ممتزة على الأكثر. |
| 6.معدل الامتزاز يسيطر عليه بالسيطرة على معدل انتقال المادة . | 6.يسيطر عليه بالسيطرة على معدل التفاعل الكيمياوي. |
| 7.سريع ,غير فعال , قابل للانعكاس.. | 7.يمكن ان يكون بطيئا ,فعال ,غير قابل للانعكاس. |
أنواع المواد المازة Adsorbents
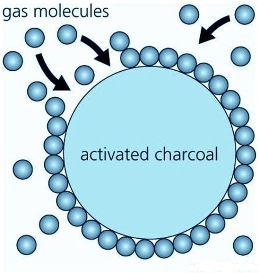
تم تطوير الماد الصلبة لفصل مدى واسع من المواد . يتم تجهيز الماد الصلبة التجارية على شكل حبيبات granules أو كرات صغيرة pellets أو تستعمل على شكل مسحوق powders أحيانا ( كما في الشكل أدناه).ويتم استعمال المواد الصلبة في دورات متعددة في اوعية عمودية حيث تمر المواد المراد معاملتها من خلالها.
خواص المواد الصلبة المازة :
1.سعة عالية للامتزاز عند حالة التعادل.
2.تسمح بأعادة تنشيطها.
3.انخفاض الضغط لها يكون قليلا.
4.السرعة الحركية في الامتزاز.
5.مقاومة للاحتكاك.
6.خاملة كيمياويا.
7.لايتغير حجمها بالتغير في درجات الحرارة وفي حالة التشبع.
8.أن لاتتكسر الى دقائق صغيرة مما يؤدي الى انسداد المسامات وتقليل الكفاءة.
ويمكن تصنيف الانتقائية السطحية للمواد الصلبة الى:
1.مواد جاذبة للماء(Hydrophilic) وتسمى ايضا بـ (Organophobic):-
مثال على هذه المواد: الالومينا الفعال وعدد كبير من زيولايت المناخل الجزيئية تملك سطوح جاذبة للماء ، ويمتز الماء بقوة اكثر مفضلا ذلك على الجزيئات العضوية ويكون سطح هذه المواد قطبية polar .
- مواد غير جاذبة للماء(Hydrophobic) وتسمى ايضا بـ (Organophilic):-
مثال على هذه المواد: الكاربون الفعال من النوع الغير الجاذب للماء ويفضل العضويات على الماء ويكون سطح الكاربون الفعال غير قطبيا no polar. أما سطح السليكا جل فيقع بين هاتين الحالتين ولها انجذاب معقول للماء والعضويات على الرغم من أن الماء يكون مفضلا.
يمكن أن يوصف السطح أما بسطحها الخارجي وذلك عندما يشمل نتوءا أو فجوات بعرض أكبر من العمق,او كسطح داخلي عندما يشمل مسامات وفجوات بعمق اكبر من العرض.ليست كل السطوح في الحقيقة ملساء
ويظهر كوديان وقمم تحت المستوى المجهري . هذه المساحات حساسة لحقول القوى .في هذه المساحات فأن ذرات المادة الصلبة يمكن ان تجذب الذرات او الجزيئات من المائع القريب منها.
الخاصية الاهم للمود المازة الصلبة والتي تعتبر حاسمة لآستعمال المادة الصلبة هي تكوين او بنية المسام .العدد الكلي للمسامات, شكلها وحجمها يحدد سعة الامتزاز وحتى معدل الامتزاز الديناميكي للمادة.
عموما تقسم المسامات الى : micropore,mesopore,macropore
وحسب تصنيف International Union of Pure Applied Chemistry والتي تعرف بـ IUPAC
تنتقل جزيئات المادة من خلال ال ((macro- الى (meso-) وأخيرا تدخل الى ال (micropores) , أن ال ( micropores) تشكل عادة الجزء الاكبر للسطح الداخلي وتساهم في معظم حجم المسام .تكون قوى التجاذب أقوى والمسامات تملئ في ضغوط نسبية واطئة في مسامات ال (micro-). ولذلك معظم عمليات الامتزاز للغازات تحدث خلال تلك المنطقة, لذا الحجم الكلي للمسام وتوزيع حجم المسام يحددان سعة الامتزاز.
| قطر المسام (nm) | النوع |
| d>50 | Macropores |
| 2≤d≤50 | Mesopores |
| d<2 | Micropores |